BPS Bioscience Inc.品牌商
5 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
推荐产品
公司新闻/正文
合成致死靶标WRN在DNA修复和肿瘤中的意义
2637 人阅读发布时间:2023-07-11 14:52
WRN是一种约162 KDa的蛋白,属于人类RECQ解旋酶家族的五个成员之一。
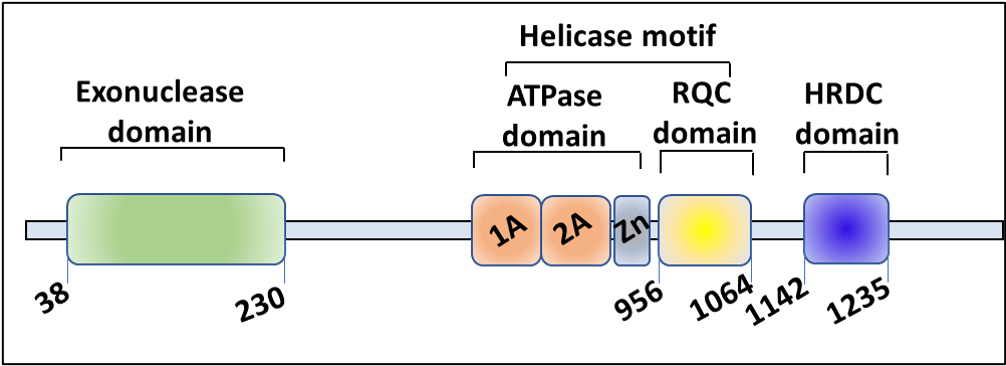
WRN由一个N-末端外切酶结构域、一个螺旋酶结构域(包括一个ATP酶和一个DNA结合的RecQ C-末端结构域)、一个蛋白质相互作用的HRDC(螺旋酶和核糖核酸酶D C-末端)结构域和一个位于C-末端的核定位信号组成。
WRN外切酶在3'到5'的方向上起作用。WRN螺旋酶能够解开DNA双链,至少具有10个核苷酸的3'或5'单链DNA突出,并且对于定位到端粒损伤部位是必要的。HRDC结构域结合DNA,并且对于招募WRN到双链DNA断裂部位至关重要。在RecQ和HRDC结构域之间的区域赋予WRN使单链DNA重结合的能力。C-末端核定位信号的突变导致WRN被导向核仁而不是细胞核。
WRN在DNA修复相关的基因组稳定性(DNA编辑、复制、DNA末端处理和切换修复过程)中发挥多方面的作用。
WRN解旋酶在DNA复制叉稳定性维持中的作用
螺旋酶和外切酶结构域可以单独或协同作用于各种DNA底物,如双链DNA断裂、DNA双链、复制叉、霍利戴联结和G-四链体。WRN可以通过经典非同源修复连接、同源重组修复或交替非同源修复连接来稳定复制叉和修复双链DNA断裂。
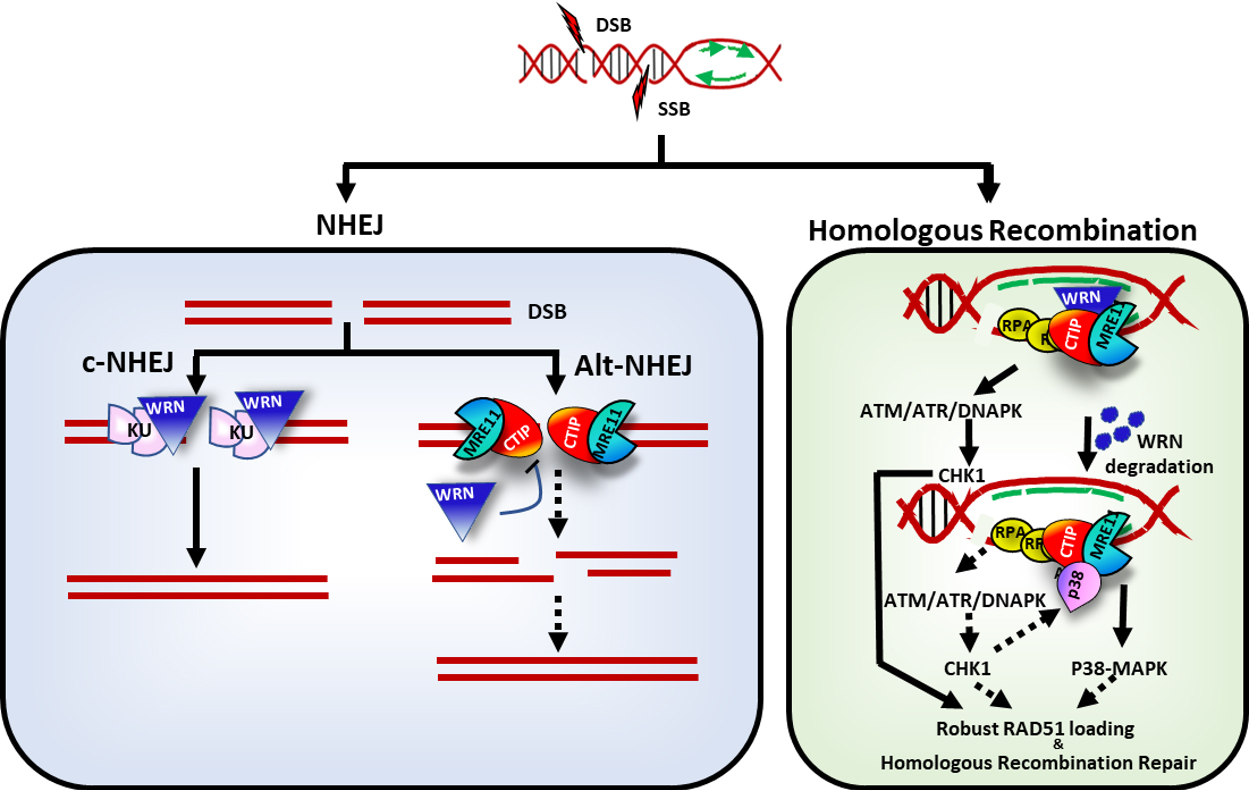
WRN在DSB修复中的c-NHEJ vs alt-NHEJ和NHEJ vs HR修复选择的作用
WRN与各种关键蛋白相互作用,参与途径切换,形成临时动态的亚复合物,选择修复过程。
在c-NHEJ途径中,WRN与KU70/80异二聚体相互作用,刺激其外切酶活性,从而参与DSB修复的过程。
WRN的催化活性对刺激c-NHEJ至关重要,而非酶性WRN则抑制MRE11-CTIP介导的alt-NHEJ。
WRN偏好NHEJ,特别是在G1期,通过抑制MRE11和CTIP对DSB位点的招募来实现。相反,依赖于细胞周期依赖性激酶1(CDK1)磷酸化WRN的丝氨酸-1133位点,可以在S期和G2期调控MRE11对DSB位点的招募,从而在HRR和NHEJ之间切换修复过程。
WRN在基因组维护和DNA G-四联体结构中的调控作用
基因组DNA的鸟嘌呤富集区会形成异常的G-四联体结构,该结构和非B形式的DNA结构和易损位点也对复制和转录机制构成了阻碍。WRN和Pol δ形成一个校对复合物,主要帮助解除非B形式的DNA结构并处理不匹配的3'末端。在易损位点中,特别是发夹结构和微卫星区域,WRN解旋酶活性促进了DNA pol δ的持续活性。
WRN和Pol δ的关联在滞后链上维持复制保真性方面起着关键作用。此外,WRN解旋酶通过促进DNA pol δ催化的DNA合成并防止微卫星区域扩展或收缩,有助于大型(CTG)n重复的发夹修复,防止出现基因组不稳定性。
WRN在端粒维护和衰老中的作用
WRN与shelterin复合物的原件结合,以确保端粒的完整性,并且与PAR化的TRF1一起修复端粒的氧化损伤。
WRN在转录和RNA代谢中的作用
WRN在复制应激下激活ATR/CHK1和ATM信号通路,ATR/CHK1通路调节Ddx19 RNA解旋酶,负责清除由复制-转录冲突产生的R-loop。然而,WRN缺乏细胞中的ATR/CHK1通路受损,导致Ddx19核定位受到破坏,进而导致R-loop清除缺陷。
在轻度复制应激下,WRN缺乏细胞中通过DSB诱导的ATM激活来抑制与R-loop相关的基因组不稳定性。
肿瘤基因诱导的复制应激会触发转录-复制冲突,进而与基因组不稳定性相关。WRN对RNA聚合酶I/II介导的转录有影响,即WRN缺乏细胞中转录水平降低。
WRN在衰老和自噬中的作用
在与年龄相关的转录调节和自噬领域,WRN对于转录烟酰胺核苷酸腺苷转移酶I和产生细胞NAD+是必需的。WRN还诱导关键的自噬蛋白,如BECLIN-1、ATG5和LC3II的产生,这些蛋白负责启动自噬并减缓衰老。
WRN是高MSI肿瘤的合成致死靶点
在具有高微卫星不稳定性(microsatellite instability,MSI)的肿瘤细胞系中,敲除WRN基因或耗竭WRN蛋白会导致合成致死。
WRN的合成致死相互作用与MMR(DNA mismatch repair)缺陷特异相关。由于缺陷的MMR系统,这些癌细胞表现出高度的MSI,即DNA中微卫星重复序列的频繁变异。
WRN的缺失导致这些癌细胞中的基因组不稳定性、细胞周期阻滞、DNA双链断裂等,最终导致癌细胞的死亡。
从机制上看,结构特异性核酸内切酶亚复合物MUS81-EME1和支架蛋白SLX4的蛋白质复合物是造成高MSI细胞(TA)重复序列周围双链DNA断裂的主要原因。基因组区域中产生非B型DNA二级结构诱导的(TA)重复基因座周围停滞复制叉的检测,这触发了基于磷酸化激活的检查点激酶ATR活化,其随后招募WRN通过其解旋酶活性来解决停滞叉。值得注意的是,(TA)重复区在高MSI细胞中重复扩增,导致非B型DNA结构在整个基因组中的积累,从而解释了WRN在这些细胞中的重要性。
临床前研究证实了WRN作为dMMR/MSI-H结直肠癌肿瘤中的合成致死靶点,可以作为单药或与靶向药物、化疗或免疫疗法联合治疗的潜在治疗方法。
因此,通过针对WRN的治疗,可以实现对MSI癌细胞的选择性杀伤,为个性化治疗提供了可能。
WRN的其他合成致死相互作用
WRN与MUS81显示出SL相互作用。在缺乏WRN的情况下,复制叉崩解会激活MUS81,MUS81会切割崩解的叉,从而产生双链断裂。MUS81在受阻的叉上产生的DSBs会启动Rad51介导的重组作用,导致复制重启,以牺牲基因组稳定性为代价确保细胞的生存能力。因此,WRN与MUS81表现出合成致死相互作用。
WRN可能在肿瘤基因诱导的复制应激期间解决异常的DNA结构。WRN的下调导致CFSs处过多的染色体断裂和细胞死亡。
在缺乏WRN的情况下,Rad51招募到崩解的复制叉中至关重要。此外,WRN在恢复暂停的复制叉过程中与组蛋白去乙酰化酶HDAC1和HDAC2的相互作用。WRN和HDAC1可能以并行途径招募Rad51来恢复暂停的复制叉。因此,WRN和Rad51也显示出合成致死相互作用。
最近的研究表明,WRN通过对CHK1-p38-MAPK轴对HRR进行调控,使WRN缺陷细胞对IR表现出高敏感性。
在体内, IR治疗与CHK1抑制剂联合应用对WRN缺陷的黑色素瘤肿瘤的生长具有强大的协同抑制作用。这表明,对WRN缺陷的肿瘤症患者进行放射治疗可能会增强治疗反应。
目前多种WRN抑制剂正在开放当中,其中NSC19630和NSC617145最具代表性。
NSC19630抑制WRN的解旋酶活性,导致复制应激相关的DNA损伤增加。此外,WRN缺陷与拓扑异构酶I的抑制剂表现出协同作用,因此与亚致死剂量的拓扑异构酶I抑制剂topotecan联合使用可导致细胞死亡增加。最近的研究表明,NSC19630以一种依赖于caspase-9的、与p53无关的方式诱导正常人上皮细胞和原代间充质细胞的凋亡和急性细胞毒性。
NSC617145通过抑制WRN解旋酶在携带Fanconi贫血(FA)通路缺陷的细胞中诱导DSB和染色体异常。NSC617145通过抑制WRN导致FA缺陷细胞中HR的废除并诱导NHEJ,对FA缺陷细胞中的交链修复发挥重要作用。
WRN螺旋酶在微卫星不稳定性癌症中具有重要的作用,是潜在的选择性杀伤治疗靶点。MSI癌细胞依赖于WRN螺旋酶活性来处理由于MMR缺陷引起的有害DNA损伤。
目前的研究表明,WRN-MSI的SL相互作用可能涉及复杂的DNA结构代谢和其他尚未完全理解的分子机制。进一步的研究将有助于深入了解WRN-MSI的SL相互作用,并为开发针对微卫星不稳定性癌症的靶向治疗策略提供基础。
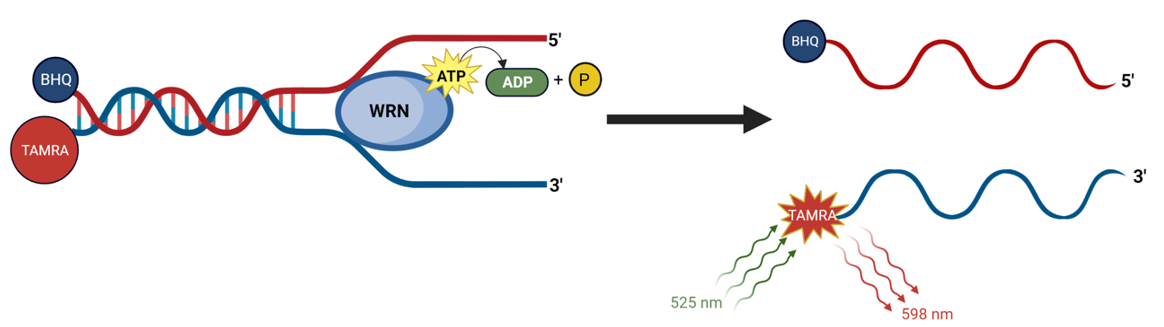
试剂盒检测原理
DNA探针一条链与TAMRA(四甲基罗丹明)荧光团集合,在另一条链与BHQ(猝灭剂)结合,DNA为双链时BHQ由于靠近TAMRA, TAMRA荧光被淬灭。由于WRN可解开DNA探针使两条链分离,释放TAMRA荧光。因此,WRN活性和TAMRA荧光强度有关。
了解BPS Bioscience更多WRN研究相关产品
WRN, GST-Tag Recombinant
WRN Helicase Activity Assay Kit
编译自:
1. Datta A, Brosh Jr R M. New insights into DNA helicases as druggable targets for cancer therapy[J]. Frontiers in molecular biosciences, 2018, 5: 59.
2. Gupta P, Majumdar A G, Patro B S. Enigmatic role of WRN-RECQL helicase in DNA repair and its implications in cancer[J]. J. Transl. Genet. Genom, 2022, 6: 147-156.
3. Morales-Juarez D A, Jackson S P. Clinical prospects of WRN inhibition as a treatment for MSI tumours[J]. npj Precision Oncology, 2022, 6(1): 85.
4. Datta A, Dhar S, Awate S, et al. Synthetic lethal interactions of RECQ helicases[J]. Trends in cancer, 2021, 7(2): 146-161.



