BPS Bioscience Inc.品牌商
5 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
推荐产品
公司新闻/正文
BPS Bioscience 推出ADAR1 荧光素酶报告基因HEK293 细胞系
1798 人阅读发布时间:2023-02-13 19:30
BPS Bioscience最近推出ADAR1 Dual Luciferase Reporter HEK293 Cell Line细胞系,其可以作为工具细胞系应用于不同的针对ADAR1的研究方向。
作用于 RNA 的腺苷脱氨酶(ADAR) 蛋白催化双链 RNA (dsRNA) 分子上腺苷转录后修饰为肌苷 (A-to-I)。 ADARs 在延伸的双链 RNA 双链体中非选择性地将 A 编辑为 I,这是一种起源古老且高度保守的活动。在人体中,ADAR1 和 ADAR2 具有脱氨活性,而 ADAR3 缺乏催化活性。 ADAR1 有两种亚型,ADAR1p110 和 ADAR1p150。较大的 p150 亚型包含核输出序列,使其能够在细胞质和细胞核中表达,而 ADAR1p110 亚型和 ADAR2 缺乏该结构域,主要位于细胞核内。 ADAR1 作为主要的 RNA 编辑器其作用可导致RNA 其他结合蛋白对 RNA 加工的差异性调节(参考文献1、2、3)。
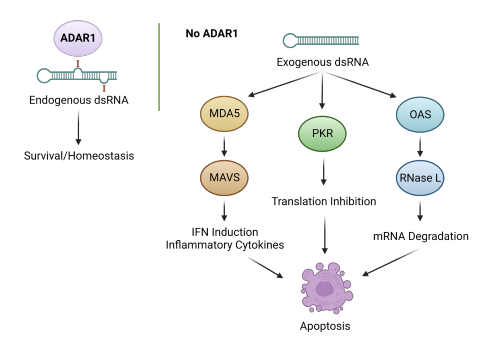
A-to-I 编辑是一种影响编码和非编码 dsRNA 的转录后机制,由作用于 RNA (ADAR) 酶家族的腺苷脱氨酶催化。 内源性 dsRNA(主要来源于 Alu 重复元件)的 A-to-I 修饰阻止了它们被细胞 dsRNA 传感器识别,从而避免了抗病毒信号的诱导和不受控制的 IFN-I 产生。 这个过程由 ADAR1 活性介导,确保激活针对外来(非自身)而非自身核酸的先天免疫反应。 因此,ADAR1 突变或其失调的活性会促进自身免疫性疾病的发展并强烈影响细胞生长,从而导致癌症。 此外,Adar1 消融促进的过度炎症也会影响 T 细胞和 B 细胞的成熟,以及树突状细胞亚群的发育,揭示 ADAR1 在免疫系统稳态中的新作用。
值得注意的是,ADAR1 可通过抑制模式识别受体机制来调节先天免疫。在病毒感染期间,长链外源 dsRNA 被 MDA5、PKR 和 OAS 识别,启动三个途径导致细胞凋亡以防止病毒传播。 MDA5 途径导致干扰素 (IFN) 基因的诱导表达,这对于对抗病毒感染至关重要。在没有病毒感染的情况下,dsRNA 的内源序列会被 ADAR1 修饰,从而阻止它们被这些先天免疫传感器识别。尽管在细胞区分外源或内源 dsRNA 中必不可少,但 ADAR1 对 RNA 的修饰可直接导致氨基酸取代,从而导致疾病。
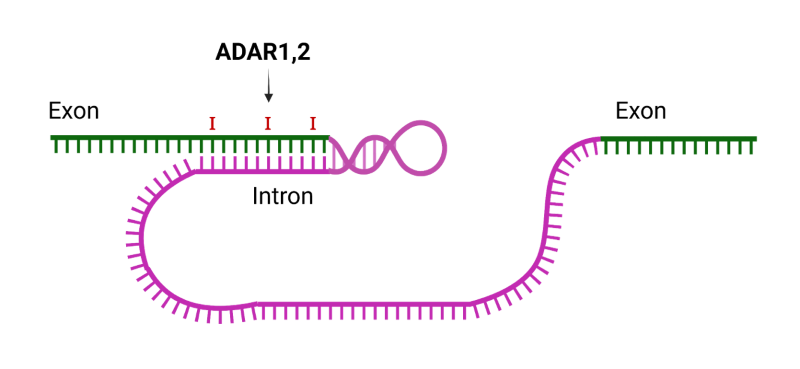
最后,ADAR1 和 ADAR2 在蛋白质多样性的转录后扩展中发挥重要作用,因为它们可以引入终止密码子、可变剪接位点和内源性前体 mRNA 中的错义突变。前体 mRNA 的 A-to-I 编辑,被翻译机器读取为 G,有时会产生不同的氨基酸,因此蛋白质的氨基酸序列与基因编码序列不同。这些变化取决于前体 mRNA 中形成双链的环的形成,编辑发生在外显子中。其中一些不同的蛋白质在发育过程中发挥作用,并受编辑器的组织特异性和时间表达的调节。
在神经系统(神经递质、离子通道、G 蛋白偶联受体)中观察到的其他变化扩展了蛋白质功能。一个众所周知的例子是谷氨酸受体,其中通过 ADAR2 将 CAG 变为 CGG(谷氨酰胺 Q 变为精氨酸 R)导致钙渗透性显着增加。血清素受体 5-HT2C 在其信使 RNA 中包含 3 个潜在修饰位点。 AQ/R 站点是编辑程度最高的站点,高达 99% 的转录本被修改,导致影响食欲和情绪的细胞内信号发生变化。
ADAR1在疾病中的作用
导致蛋白质功能受损的 ADAR1 特定基因突变与几种 IFN 介导的疾病有关,包括 Aicardi-Goutieres 综合征、遗传性对称性色素异常症、双侧纹状体坏死和痉挛性截瘫。类风湿性关节炎 (RA) 和系统性红斑狼疮 (SLE) 等自身免疫性疾病也与 ADAR1 相关,在 RA 患者中观察到 ADAR1p150 过表达,在 SLE 患者中观察到高水平的 A-to-I 编辑。重要的是,ADAR1 过度活跃或功能丧失都与各种癌症以及癌症的潜在治疗方式有关。随着检查点阻断免疫疗法的出现,研究人员继续寻找增强疗效的机制,尤其是针对实体瘤的疗效。 ADAR1 本身可以充当免疫检查点。现在的研究已经确定,使肿瘤细胞中的 ADAR1 失活会使它们对免疫疗法高度敏感,这一过程与未经编辑的 dsRNA 和诱导 IFN 通路的模式识别受体的激活有关。
ADAR1 可以通过几种不同的机制影响肿瘤发生。首先,特定转录本的 ADAR1 RNA 编辑与某些类型的癌症及其致病性有关。特别是,AZIN1、DHFR、FAK、GLI1、MYC 和 RHOQ mRNA 的编辑与肿瘤发生增加或治疗耐药性增加有关。其次,编辑肿瘤抑制 miRNA,特别是 let-7 miRNA,导致它们的生物发生减少,从而促进慢性粒细胞白血病的自我更新。另一方面,ADAR1 对其他 miRNA 的活性发挥肿瘤抑制作用。例如,ADAR1 降低了 miR-378 和 miR-455 的水平,它们是肿瘤抑制因子的抑制剂。这种调节与限制黑色素瘤的进展和生长有关。最后,ADAR1 编辑可以限制癌症中的选择性剪接,正如 CCDC15 外显子 9 所观察到的那样,这是一种致瘤性剪接变体,可因 ADAR1 的活性而降低。
用于筛选 ADAR1 抑制剂的新型荧光素酶报告细胞系
基于 K. Fritzell 等人描述的类似报告系统。 (4) 、BPS Bioscience发布了第一个商业化的基于荧光素酶的报告细胞系,用于筛选ADAR1的抑制剂。该细胞系在 CMV 启动子的控制下表达 ADAR1,在单独的 CMV 启动子的控制下表达 ADAR 编辑 RNA 报告构建体。报告基因包含编码萤火虫荧光素酶的基因,该基因在细胞中组成型表达,位于编码 GluA2 ADAR 底物的基因上游,随后是海肾荧光素酶基因。对应于 GluA2 的序列已被修改为包含一个琥珀终止密码子 (UAG)。当由 ADAR 编辑时,此终止密码子 (UAG) 将更改为色氨酸代码(UIG,其中 I 翻译解释为 G),从而导致海肾荧光素酶 (A) 的表达。相反,在没有 ADAR1 活性的情况下,翻译在终止密码子处终止,海肾不表达。报告基因活性读出为海肾荧光素酶/萤火虫荧光素酶比率,从而在抑制 ADAR 活性 (B) 时读取 UAG(终止)密码子,导致海肾荧光素酶表达减少和海肾荧光素酶/萤火虫表达减少荧光素酶比率。
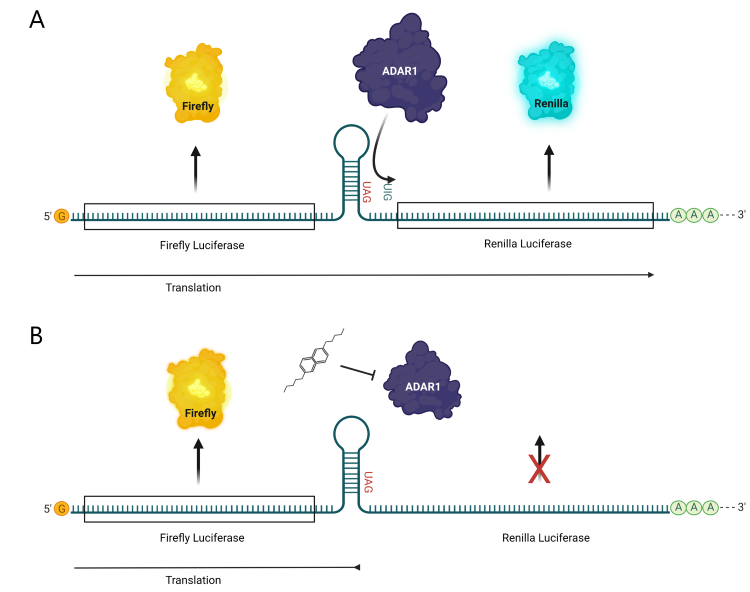
该细胞系统可作为用于高通量化合物筛选以鉴定特定 ADAR1 抑制剂的出色解决方案。
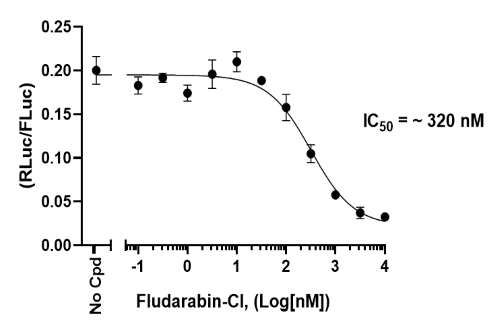
ADAR1 Luciferase Reporter-HEK293 细胞对 Fludarabin-Cl 的剂量反应。用增加剂量的 Fludarabin-Cl 处理细胞 30 小时,并使用双重荧光素酶(萤火虫-海肾)测定系统测量萤火虫和海肾荧光素酶活性。结果显示为海肾/萤火虫荧光素酶比率。
References
1. B. Song, et al. 2022. Wiley Interdiscip Rev RNA. 13(10):e1665. Pubmed
2. L. Xu and M. Ohman. 2018. Genes (Basel). 10(1):12. Pubmed
3. M. Lamers, et al. 2019. Front Immunol. 10:1763. Pubmed
4. K. Fritzell, et al. 2019. Nucleic Acids Res. 47(4):e22. Pubmed



