BPS Bioscience Inc.品牌商
5 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
推荐产品
公司新闻/正文
GLP-1R 和糖尿病-BPS Bioscience
1309 人阅读发布时间:2023-03-04 19:41
GLP-1R 结构和功能
胰高血糖素样肽1受体(GLP-1R)是B类G蛋白偶联受体家族的成员(1)。人GLP-1R由463个氨基酸组成,包括七个跨膜结构域和一个N末端信号肽,在运送至细胞膜时会被切割(2)。GLP-1R和其他B类G蛋白偶联受体的典型结构特征是大的N末端细胞外结构域(ECD)。B类G蛋白偶联受体通常通过称为双结构域模型的机制结合它们的肽配体,其中ECD结合GLP-1的C末端螺旋,跨膜结构域(TMD)结合GLP-1的N末端区域-1(3,4,5)。已知TMD内的极性残基调节受体的信号传导偏向(3),而跨膜螺旋边界和细胞外表面是激动作用的触发器(4)。GLP-1R在胰腺和中枢神经系统中高表达,但在肠道、肾脏、肝脏、心脏、肌肉和PNS中表达水平较低(6)。
胰高血糖素样肽-1(GLP-1)是GLP-1R的天然配体。它是一种由31个氨基酸组成的长肽激素(7),主要由远端小肠中的L细胞内分泌、胰腺中的α细胞以及位于脑干尾部孤束核中的前胰高血糖素原(PPG)神经元分泌(6)。GLP-1与其受体GLP-1R相互作用并调节葡萄糖稳态。因此,它是2型糖尿病(T2D)治疗的一个极具吸引力的目标。GLP-1或GLP-1R激动剂显示出多种多样的生理功能,如下图所示。
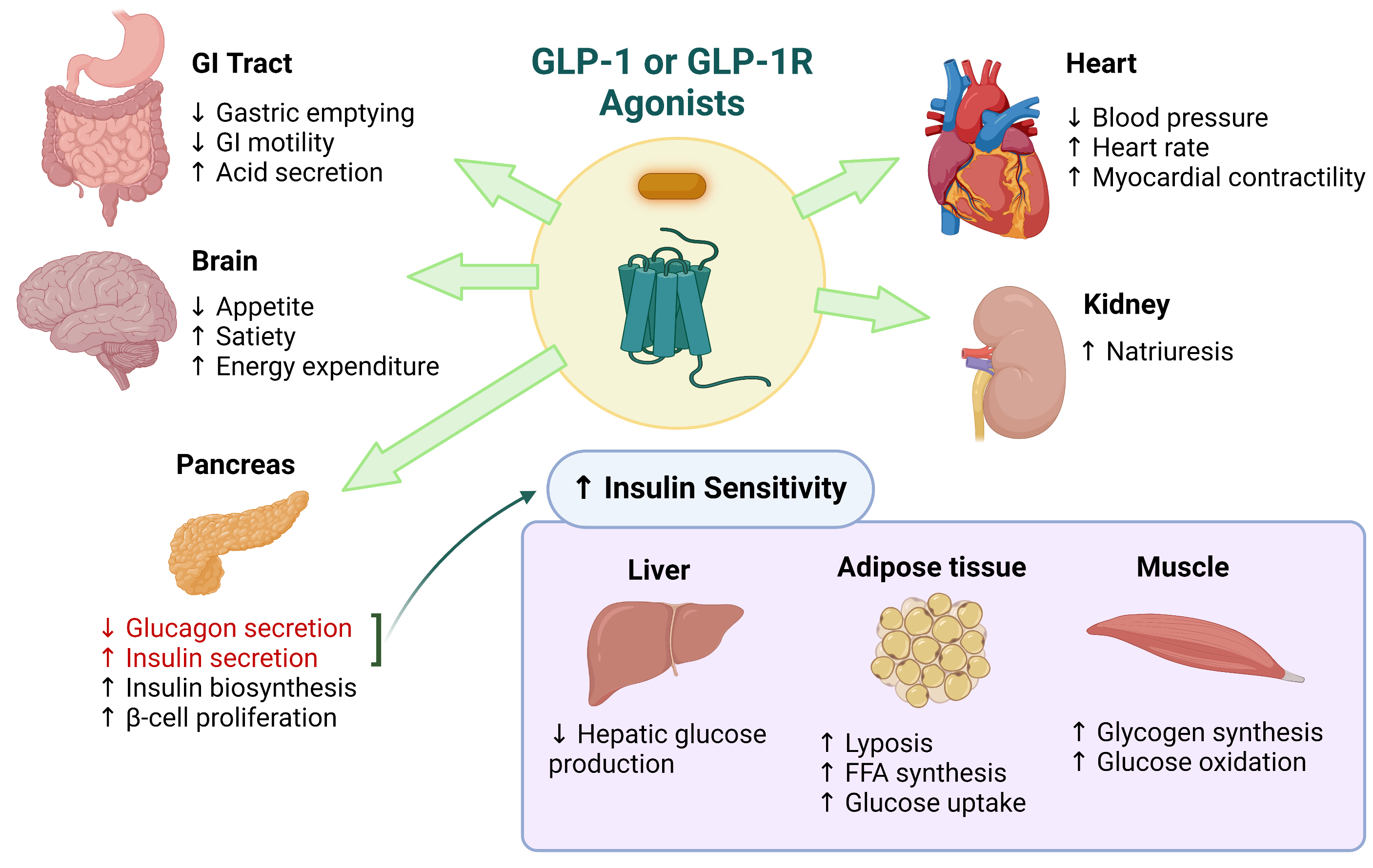
此图使用 Biorender.com 创建。图片改编自Saraiva, FK 和 Sposito, A. 发表于 2014 年的期刊 Cardiovascular Diabetology 中的文章,文章标题为 "Cardiovascular complications in patients with diabetes: a review"。原始文章链接为:http://www.cardiab.com/content/13/1/142。
GLP-1R 信号传导
GLP-1与GLP-1R的结合会激活下游信号级联,有效促进胰岛素分泌并抑制胰高血糖素的释放。GLP-1R的下游激活可快速激活腺苷酸环化酶并增加cAMP的分泌。cAMP可直接激活蛋白激酶A(PKA)和cAMP调节的鸟嘌呤核苷酸交换因子2(Epac2),二者协同作用产生下游信号,导致胰岛素分泌增加。GLP-1R的激活还可通过PKA激活的肌醇1,4,5三磷酸受体和Epac2激活的兰尼碱受体从内质网释放Ca2+,进而增加细胞内Ca2+。因此,GLP-1R不仅能与Gαs偶联,还能与其他Gα亚型(包括Gαi和Gαq)偶联。GLP-1R还可通过G蛋白非依赖性途径(即β-抑制蛋白介导)发出信号。
GLP-1 信号还通过 β 细胞中的 cAMP/PKA 依赖性通路抑制电压依赖性 K+ (Kv) 通道,从而降低 Kv 电流并防止 β 细胞复极化。这使得电压依赖性 Ca2+ 通道 (VDCC) 打开,Ca2+ 流入胰岛素从 β 细胞中分泌 (13)。因此,cAMP 产生和 Ca2+ 流入的结合是胰岛素生物合成和分泌的重要组成部分 (10)。
GLP-1R 作为糖尿病和其他疾病的靶点
2型糖尿病,也称为成年型糖尿病,是全球人群中最常见的糖尿病类型之一,影响超过4.5亿人,相当于全球人口的6%以上。该疾病的发生是由于遗传和生活方式因素的结合,导致胰腺β细胞产生胰岛素的缺陷,以及对位于身体周围和中央组织的胰岛素受体的吸收产生抵抗。长期的高血糖以及相关的不良代谢特征,如血脂异常和慢性炎症,最终会导致一系列健康问题,如心血管疾病、周围神经病变、糖尿病酮症酸中毒、糖尿病视网膜病变和糖尿病肾病。目前,已有的抗糖尿病药物通过增加身体对胰岛素的敏感性、增强胰岛素分泌或减少肾葡萄糖重吸收来改善血糖控制。然而,这些药物会引起过多的副作用,例如体重增加、水肿、肠道不适和低血糖症等 (2)。
近年来,胰高血糖素样肽 1 受体激动剂 (GLP-1RAs) 已被广泛应用于治疗糖尿病和肥胖症,这些药物已被证明是安全有效的。激活 GLP-1R 后,会引发下游信号通路,从而降低血糖水平,包括增加胰岛素分泌、减少胰高血糖素分泌以及提高胰岛素敏感性,减轻体重并增加饱腹感 (2)。由于 GLP-1RA 可以通过葡萄糖依赖性刺激胰岛素分泌,因此其低血糖的风险较低。到目前为止,GLP-1RA 是少数被批准用于降低血糖的 G 蛋白偶联受体 (GPCR) 配体 (2)。
目前多种 GLP-1RA 和类似物,如 Exendin-4 和利拉鲁肽,已成功用于治疗 T2D (7)。利拉鲁肽于2014年成为最早在美国市场上引入的用于治疗肥胖和体重管理的 GLP-1RA 药物 (12)。GLP-1RA 的治疗效益已经超越了 T2D 和肥胖的治疗。研究表明,GLP-1RA 可以通过降低血压、刺激神经细胞分化和抑制神经炎症,以及抑制肝脏炎症来改善心血管健康 (7)。此外,GLP-1 和 GLP-1RA 还表现出通过逆转许多与抑郁症相关的适应不良大脑变化,从而发挥抗抑郁作用的潜力 (13)。
除了美国FDA批准的 GLP-1RA 外,目前还有 GLP1/胰高血糖素双激动剂(Cotadutide,BI 456906)、GIP/GLP1双激动剂(Tirzepatide,GIP/GLP肽I和II)、GIP/GLP1/胰高血糖素三激动剂(HM15211,GGG 三激动剂)和 GLP1R 激动剂(Efpeglenatide,Rybelsus)正在进行针对 T2D、肥胖症和 NASH 治疗的 1-III 期临床试验 (12)。GIP(葡萄糖依赖性促胰岛素多肽或胃抑制多肽)是一种肠道激素,作用于其受体 GIP-R 以刺激胰岛素分泌。因此,GLP-1RA 和 GIP-RA 可能成为治疗多种疾病的潜在方法。
特色产品
GLP-1R/CRE (Luc) 报告基因 – HEK293 重组细胞系
这种 HEK293 细胞系被设计用于在细胞表面激活 GLP-1R 时产生强大的荧光素酶信号。它可用于测试多种重组 GLP-1 及其受体激动剂的活性。该细胞系是筛选 GLP-1 激动剂活性候选分子和确定 EC50 剂量的理想选择。
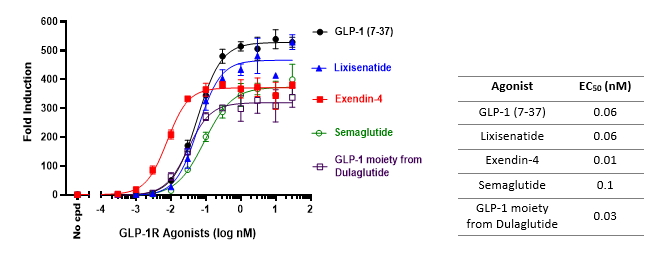
References:
(1) Dillon JS, et al. 1993. Endocrinology. 133 (4):1907–10.
(2) Marzook A, et al. 2021. Front Endocrinol. 12:678055. doi: 10.3389/fendo.2021.678055
(3) Wootten D, et al. 2016. Molecular Pharmacology. 89 (3):335–47.
(4) Wootten D, et al. 2016. Cell. 165 (7):1632–1643. doi:10.1016/j.cell.2016.05.023
(5) Yang D, et al. 2016. J Biol Chemistry. 291 (25):12991–3004.
(6) Rowlands J, et al. 2018. Front Endocrinol. 9:672. doi: 10.3389/fendo.2018.00672
(7) Zhao X, et al. 2021. Front Endocrinol. 12:721135. doi: 10.3389/fendo.2021.721135
(8) Carlessi R, et al. 2017. Sci Rep 7, 2661.
(9) Portha B, et al. 2011. Exp Diabetes Res. 2011:376509. doi: 10.1155/2011/376509.
(10) Cassandra Koole, et al. 2013. Molecular Endocrinology, 27:1234–1244.
(11) https://www.who.int/news-room/fact-sheets/detail/diabetes
(12) Müller TD, et al. 2022. Nat Rev Drug Discov. 21:201–223 (2022).
(13) Detka J, and Głombik K. 2021. Pharmacol Rep. 73:1020–1032.
访问:https://bpsbioscience.com/glp-1r-diabetes了解更多相关信息,BPS Bioscience Inc.提供相关的产品和检测服务。



