BPS Bioscience Inc.品牌商
5 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
推荐产品
公司新闻/正文
CAR-T 细胞的功能验证 -BPS Bioscience
6304 人阅读发布时间:2023-11-01 17:45
CAR-T 细胞在癌症免疫治疗中的最终功能是杀死肿瘤细胞。CAR-T 一旦激活,细胞毒性T细胞会触发靶细胞的凋亡,不过当肿瘤细胞凋亡通路被抑制,仍可能发生其他死亡机制。
从原理上来看,T 细胞的激活是通过 CAR 的抗体 ScFv 部分与肿瘤细胞表面的抗原结合来启动的。CAR 的胞内信号传导部分激活了多个信号通路,最终导致转录因子如 NFAT(活化T细胞核因子)的激活、基因转录的增加以及死亡配体 FasL(Fas配体)和 TRAIL(TNF 相关凋亡诱导配体)的释放。这些结合到肿瘤细胞上的特定死亡受体上,激活程序性细胞死亡。此外,T 细胞的颗粒外排途径被激活,穿孔素(perforin)和颗粒酶家族的丝氨酸蛋白酶释放到免疫突触中,直接促进肿瘤细胞的溶解(参见[1])。
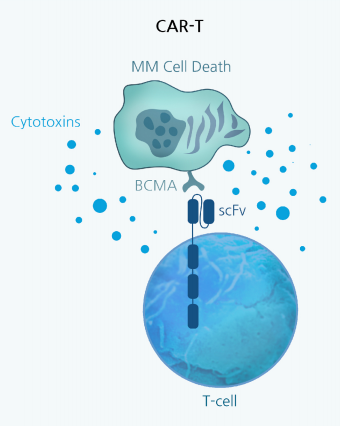
除了释放死亡信号外,T细胞在体外和体内激活后会产生肿瘤坏死因子 -α(TNF-α)和干扰素 -γ(IFN-γ),这表明 TNF-α 和 IFN-γ 的释放可能是它们功能的先决条件。IFN-γ 是主要由激活的T细胞和自然杀伤(NK)细胞分泌的细胞因子,它在先天免疫和适应性免疫中发挥重要作用。临床上,输注抗 CD19 CAR-T 细胞的患者血清水平的 IFN-γ 和 TNF-α 的提高。这些患者的外周血T细胞在体外以 CD19 依赖的方式产生 IFN-γ,表明 CAR-T 细胞是这种细胞因子释放的原因[2]。
功能表征可以说是 CAR-T 细胞开发过程中最重要的步骤之一。除了确保 CAR 被正确激活外,功能性试验还应该证明是否能让肿瘤细胞的死亡,因为这是 CAR-T 细胞的最终目的。在具体的实验中,可以将 CAR-T 细胞与表达靶点抗原(例如 CD19 或 BCMA)的目标肿瘤细胞共培养,测量培养基中 T 细胞释放的细胞因子的含量,并评估肿瘤细胞的存活情况,这是功能验证的重要手段(如使用报告基因系统进行评估)。
抗 CD19 和抗 BCMA 的 NFAT-荧光酶报告基因 Jurkat 细胞用于优化或测试抗原呈递细胞,优化共培养试验条件,并确保在特定试验中适当的 T 细胞激活。荧光素酶报告基因由一个含有 NFAT 响应元件的启动子控制,用于监测 CAR 下游的 CD3 信号传导域的激活,当细胞与抗原呈递细胞接触时,激活转录因子 NFAT。除了条件性荧光素酶外,抗 BCMA CAR/NFAT-荧光酶报告基因 Jurkat 细胞系稳定表达抗 BCMA CAR 结构。当这些重组 Jurkat 细胞加入 BCMA 呈递细胞时,NFAT 转录因子被激活并诱导荧光素酶表达,如图 1 所示(可以进行定量检测)。
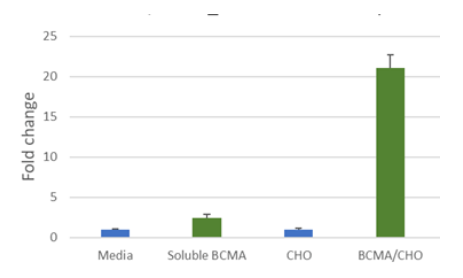
图1:anti-BCMA CAR NFAT-luciferase Jurkat cell 的 BCMA 依赖性激活。
anti-BCMA CAR NFAT-luciferase Jurkat cell(#79694):单独培养,在可溶性 BCMA 存在下培养,在对照 CHO 细胞存在下培养,或在 BCMA 呈递的 CHO 细胞存在下以 10 比 1 的比例(效应细胞与靶细胞)培养。使用 ONE-StepTM 荧光酶检测试剂盒(#60690)测量荧光素酶活性。
当 Jurkat 细胞单独培养或与不表达 BCMA 的对照 CHO 细胞一起培养时,细胞未被激活。添加可溶性 BCMA 导致荧光素酶活性增加 4 倍,而有 BCMA 的 CHO 细胞诱导荧光素酶活性增加 23 倍。
由于 IFN-γ 是 T 细胞激活的重要指标,测量其在靶细胞识别下的释放是 CAR-T 细胞功能验证的常规工作。IFN-γ Colorimetric ELISA Detection Kit 可用于定量检测细胞培养基中的人 IFN-γ。
检测原理:将抗 IFN-γ 捕获抗体包被到 96 孔板上。含有 IFN-γ 的测试样品在已经包被的孔板上孵育。板洗涤后,加入抗 IFN-γ 检测抗体。洗涤后,加入链霉亲和素-HRP,并加入一种比色 HRP 底物。如图 2 所示,该检测方法在 2 pg/ml 至 500 pg/ml 之间是线性的。该检测试剂盒可用于测量与抗原呈递细胞共同培养的 CAR-T 细胞产生的 IFN-γ。如果 CAR-T 细胞被适当激活,它们会释放细胞因子到培养基中,可以对培养基进行检测。
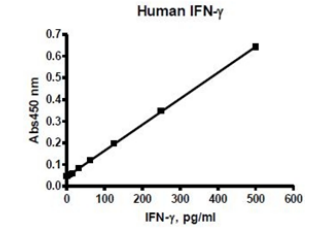
图2:人IFN-γ的定量检测
使用 IFN-γ Colorimetric ELISA Detection Kit(#79777),通过将不同浓度的纯化 IFN-γ(2 pg/ml至500 pg/ml)孵育在包被有捕获抗体的板上进行验证。使用紫外/可见分光光度计检测颜色比色信号。
图3展示了在共培养试验中测量 IFN-γ 的一个例子。
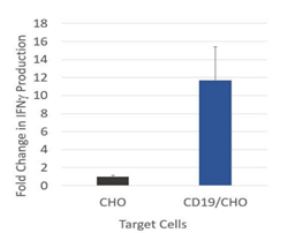
图3. 抗 CD19 CAR-T 细胞在共培养中产生的 IFN-γ
使用抗 CD19 CAR 慢病毒转导的 CAR-T 细胞与 CD19 表达的 CHO 细胞(#79561)或对照的 CHO 细胞以 10 比 1 的比例共培养 16 小时。使用 IFN-γ Colorimetric ELISA Detection Kit(#79777)检测 IFN-γ 表达量。结果相对于 CAR-T 细胞和对照 CHO 细胞共培养的 IFN-γ 表达量设置为 1。
在这个实验中,来自供体的原始 T 细胞被稳定转导了抗 CD19 CAR 慢病毒。12 天后,CAR-T 细胞与 CD19 表达的 CHO 细胞或对照的 CHO 细胞一起培养。使用 FN-γ Colorimetric ELISA Detection Kit 检测 IFN-γ 的分泌量。与对照 CHO 细胞一起培养的抗 CD19 CAR-T 细胞相比,与 CD19 表达的 CHO 细胞一起培养的抗 CD19 CAR-T 细胞产生的 IFN-γ 多 12 倍,这表明 T 细胞通过 CD19 细胞的呈递被适当地激活了。
评估 CAR-T 细胞功能最相关的功能检测是验证其靶肿瘤细胞的细胞毒性。一般使用共培养试验进行检测,其中 CAR-T 细胞与呈递抗原的肿瘤细胞一起培养,并对存活的肿瘤细胞数量进行定量。一般可以在肿瘤细胞中添加一个报告基因(如,eGFP--绿色荧光蛋白),这样就可以通过荧光来进行定量检测了。另外,也可以让肿瘤特异性表达萤火虫荧光素,这样就可以通过对荧光素酶活性进行检测(该活性与细胞培养中存在的活细胞数量成正比),从而得到灵敏而可靠的检测的结果。

图4:使用荧光素酶阳性靶细胞的共培养检测示意图。
在共培养测定的开发过程中,使用一个已知的 CAR-T 细胞系统进行试验条件优化,以及在后续实验作为阳性对照或内部对照对整个检测非常重要。
为了评估表达抗 CD19 CAR 结构的 CAR-T 细胞的 CD19 靶向活性,可以将 CAR-T 细胞加入到 CD19 荧光素酶稳转 CHO 细胞系进行共培养。如图 5 所示,CHO 细胞呈递 CD19 导致抗 CD19 CAR-T 细胞被激活并杀死 CHO 细胞,这可以通过荧光素酶活性的降低进行检测。如预期的那样,不表达 CAR 结构的阴性对照 T 细胞没有杀死 CD19 荧光素酶稳转 CHO 细胞。
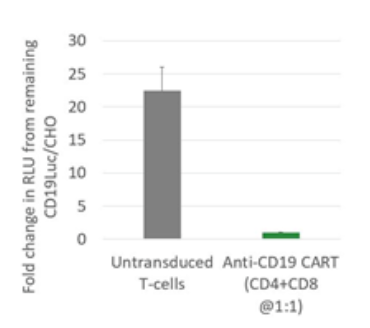
图5:抗 CD19 细胞毒性测定
通过抗 CD19 CAR 慢病毒转导原代 T 细胞,并在抗生素选择条件下扩增了 12 天。得到的抗 CD19 CAR-T 细胞与表达 CD19 的 CHO 荧光素酶细胞(#79714)共培养(比例为 10 比 1),持续培养 16 小时。未转导的 T 细胞被用作阴性对照。使用 ONE-Step 荧光素酶检测试剂盒(#60690)检测荧光素酶活性。
Bibliography
1. Martínez-Lostao L, Anel A, Pardo J. How Do Cytotoxic Lymphocytes Kill Cancer Cells Clin Cancer Res. (2015) 21: 5047-5056. PMID: 26567364.
https://pubmed.ncbi.nlm.nih.gov/26567364/
2. Kochenderfer JN, Dudley ME, Feldman SA, et al. B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood (2012) 119: 2709-2720. PMID: 22160384.
https://pubmed.ncbi.nlm.nih.gov/22160384/



