BPS Bioscience Inc.品牌商
5 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 2.2
- 2.2
推荐产品
公司新闻/正文
靶向“不可成药”的Wnt通路靶点
2302 人阅读发布时间:2023-07-21 16:14
01 Wnt信号通路
Wnt介导的信号在调控胚胎发育、组织稳态和细胞命运决定等多种细胞过程中的保守进化作用。Wnt信号通路包括Wnt配体、Frizzled受体(FZD家族)、共受体、β-Catenin降解复合物、β-Catenin/转录合作伴侣以及其他调控组分。Wnt是一种分泌的配体,通过其受体和下游效应物传导自分泌和旁分泌信号。Wnt配体/受体的细胞内下游信号传导根据其对β-Catenin的依赖性被广泛划分为β-Catenin依赖信号(经典Wnt信号)和β-Catenin非依赖信号(非经典Wnt信号)。

Wnt信号通路及其在不同癌症中的变化
β-Catenin依赖和非依赖Wnt信号的信号传导,以及不同肿瘤中Wnt信号通路组成原件的变异频率。
1.1 Wnt配体和受体
哺乳动物中已经发现了19种分泌型Wnt配体和超过18种Wnt受体/共受体。
Wnt配体是一种脂质修饰的糖蛋白。它的胞外分泌需要通过蛋白酯酰基转移酶(PORCN)介导的蛋白酰基化。酰基化的Wnt配体与Wntless结合,并从高尔基体转运到细胞膜进行分泌。分泌的Wnt被FZD受体家族所识别后向胞内传导Wnt信号。
与FZD结合的LRP5/6是一种典型的共受体。
RNF43或ZNFR3是跨膜E3连接酶,通过降解FZD受体降解负调控Wnt信号。
R-spondins(RSPO1-4)是Wnt信号增强剂。R-spondins与LGR4-6和RNF43/ZNFR3复合物结合阻止了RNF43/ZNFR3介导的FZD的溶酶体降解,从而维持了Wnt信号传导。
1.2 β-Catenin依赖信号
AXIN、APC、CK1、GSK3β和βTrCP组成β-Catenin降解复合物,它严格控制着细胞质β-Catenin的水平。在没有Wnt配体的情况下(Wnt off),降解复合物中的GSK3β和CK1磷酸化β-Catenin。磷酸化后的β-Catenin随后由E3连接酶βTrCP泛素化并降解。在Wnt配体刺激下(Wnt on),AXIN与磷酸化的LRP5/6胞质尾部和FZD受体适配蛋白Disheveled(Dvl)结合,Dvl负调控多亚基复合物对β-catenin的降解作用。这促进了β-catenin的累积和核转位,与T细胞因子/淋巴样增强因子 (TCF/LEF)等共激活因子相互作用,激活包括c-Myc、Axin2、CCND1和CD44等在内的Wnt下游的靶基因转录。
1.3. β-Catenin非依赖信号
在β-Catenin非依赖信号中,Wnt/受体相互作用的细胞内下游信号传导主要通过如,RAC1-JNK、RHOA-ROCK和PLC-IP3-Ca2+进行的。
在肿瘤中,Wnt信号的遗传改变主要表现在APC、ZNRF3、CTNNB1(编码β-Catenin)、AXIN1和RSPOs等基因的突变。研究表明,抑制Wnt信号的过度活化已显示出良好的抑制肿瘤效果。
2.1 肿瘤中Wnt信号传导的变化
在结直肠癌(CRC)中, APC的突变频率约为60~80%,CTNNB1的突变频率约为5~10%。APC和CTNNB1的突变通过稳定β-Catenin引起Wnt信号过度激活,从而引发肠道肿瘤。
在胃癌(GC)中,检测到13~22%的APC突变。APC突变足以在体内模型中引发胃肿瘤,证明Wnt信号突变在GC发生过程中的驱动作用。另一个Wnt信号组分RNF43的突变在MSS(微卫星稳定)亚型(GC患者的约20%)中约为4.3%,在MSI(微卫星不稳定)亚型(患者的约80%)中约为54.6%,也是关键的驱动突变。多个证据证明,Wnt信号在胃癌中既参与肿瘤驱动又促进肿瘤发展的作用。
在肝细胞癌(HCC)中,约50%的Wnt信号通路突变是激活突变。约20~25%的CTNNB1(编码β-Catenin)、约10%的AXIN1和约3%的AXIN2发生突变。此外,FZD3、FZD6和FZD7受体、Wnt 3、Wnt4、Wnt 5A配体以及调节因子RSPO2在HCC中过表达。这些Wnt信号的遗传变异与肝细胞癌(HCC)的进展密切相关。
2.2 Wnt信号的改变促进肿瘤发展
除了Wnt信号的致癌作用外,特定肿瘤中的Wnt信号遗传改变并不驱动肿瘤发生,起到促进肿瘤进展的作用。此外,支持肿瘤生态环境的Wnt信号对于促进各种原发性和转移性癌症的发展至关重要。
在肺癌中,Wnt信号的过度激活与肿瘤形成、复发和预后不良相关。在小细胞肺癌(SCLC)中,APC和CHD8的突变与SCLC的复发有关,CHD8抑制了由CTNNB1介导的转录。在非小细胞肺癌(NSCLC)中,Wnt配体(Wnt1、Wnt2、Wnt3和Wnt5a)和其他信号模块(FZD8、PORCN和TCF-4)过表达。Wnt产生的生态环境对于肺腺癌的肿瘤发生至关重要。
胰腺导管腺细胞癌(PDAC)中大约有4~10%的RNF43突变和<1%的APC和CTNNB1突变。Wnt信号的激活参与了胰腺肿瘤发生,抑制FZD和Wnt配体之间的相互作用可以阻止肿瘤发生。
Wnt异常活化会引发或促进肿瘤发生,因此,靶向 Wnt通路下调或恢复过度激活的Wnt信号可用于肿瘤的治疗。
Wnt靶向策略可以分为四类:靶向Wnt配体、靶向Wnt受体、靶向降解复合物和靶向β-Catenin/转录因子。细胞外的Wnt配体和受体是特异抗体的良好靶点。然而,细胞内信号传导组分无法通过抗体进行靶向。只有小分子化合物和肽段可用于靶向这些组分。因此,Wnt信号组分的酶活性区域是细胞内组分的关键靶点。
肿瘤治疗中靶向Wnt信号通路的临床试验
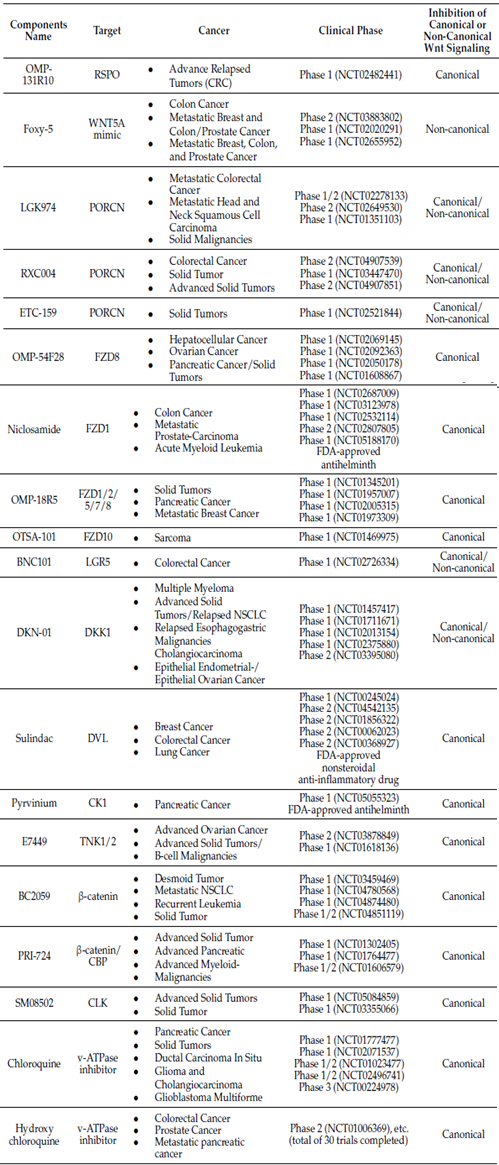
靶向Wnt通路的临床前靶向剂
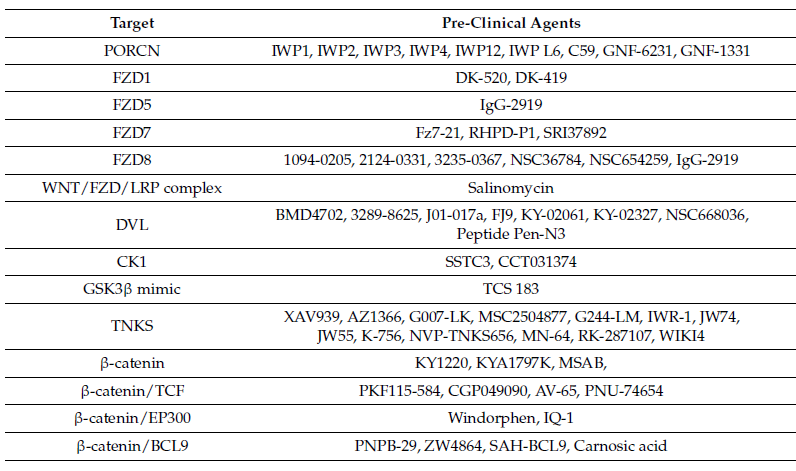
临床试验中的肿瘤Wnt信号调节剂
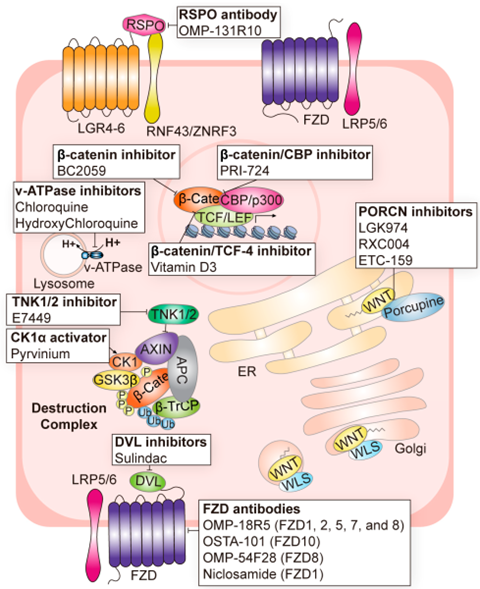
针对Wnt信号通路的靶点及其针对这些靶点的靶向剂
3.1. 靶向Wnt配体
靶向特定的Wnt配体在特定的肿瘤类型中可以增加癌症治疗特异性。然而, Wnt配体和肿瘤类型的对应关系仍然不明确,此外,在大多数情况下,Wnt信号中的突变主要发生在Wnt配体的下游,因此,靶向Wnt配体可能效果有限。
PORCN抑制剂LGK974(也称为WNT974)通过抑制Wnt的酰化过程,阻止Wnt的分泌,显示出显著抑制肺肿瘤发生和转移性结直肠癌进展的效果。其他PORCN抑制剂,如RXC004在胰腺癌异种移植瘤和胃癌PDX模型中抑制肿瘤生长。ETC-159抑制所有Wnt配体的分泌和活性。
可溶性FZD相关蛋白(SFRP)可以抑制Wnt信号通路。SFRP具有类似于FZD结构域的富含半胱氨酸结构域(CRD)。该结构域作为SFRP与Wnt配体竞争性结合,以抑制Wnt信号。V3Nter是一种基于SFRP的多肽,能够与Wnt3A结合并抑制结直肠癌中的Wnt信号。
DKK(Wnt调节因子)由五种类型组成,其中DKK1与LRP5/6结合,它是抑制经典Wnt信号的调节因子,同时,DKK1也与激活非经典Wnt信号通路相关。抑制DKK1能够抑制多种癌症的肿瘤发生。DKN-01是一种人源化抗体,能够与DKK1结合,抑制癌症的发展。
3.2. 靶向Wnt受体
细胞表面受体相对容易开发抗体,使Wnt受体成为有吸引力的药物靶点。
OMP-18R5单克隆抗体(mAB)可结合五种FZD受体(FZD1、FZD2、FZD5、FZD7和FZD8),并阻断经典Wnt通路。这种OMP-18R5单克隆抗体可以抑制结肠癌、乳腺癌和胰腺癌细胞的肿瘤生长。
OTSA-101是一种针对FZD10的单克隆抗体,正在进行肉瘤的一期临床试验。
OMP-54F28融合蛋白具有FZD8的细胞外N末端富含半胱氨酸的结构域(CRD)。通过竞争性抑制FZD8,OMP-54F28抑制Wnt配体的信号传导。
R-spondin可以诱导FZD受体的积累并增强Wnt信号传导。因此,RSPO可能是Wnt信号的治疗靶点。
OMP-131R10(Rosmantuzumab)是一种针对R-spondin 3(RSPO3)的单克隆抗体,已经完成了针对晚期实体瘤或复发性肿瘤的一期临床试验。
3.3 靶向β-Catenin降解复合物
β-Catenin降解复合物(APC、CK1、AXIN和GSK3β等组成)在控制细胞质和核β-Catenin浓度方面起着关键作用。因此,恢复降解复合物的功能或增强其功能对于癌症治疗是必要的。
CK1和GSK3β磷酸化β-Catenin,随后诱导β-Catenin泛素化并降解。因此,激活CK1和GSK3β可以增强降解复合物的功能。
Pyrvinium是一种FDA批准的药物,它通过增强CK1激酶活性来抑制Wnt信号。
SSTC3是一种临床前期的CK1小分子激活剂,其药代动力学性能优于现有的CK1激活剂。CCT031374是一种临床前期的GSK3β激活剂,通过诱导野生型β-Catenin的降解来作为Wnt信号抑制剂。
Sulindac是一种FDA批准的非甾体抗炎药。Sulindac通过与Dvl的PDZ结构域结合,阻断细胞膜上的降解复合物,从而抑制Wnt/β-Catenin通路。
增强降解复合物介导的β-Catenin降解的另一种方式是稳定AXIN。
E7449是一种PARP(Poly(ADP-ribose)聚合酶)1/2和端锚聚合酶(TNKS)1/2抑制剂。端锚聚合酶属于多聚ADP核糖聚合酶家族,能够诱导AXIN的蛋白酶体降解。因此,抑制端锚聚合酶可以显著增加AXIN蛋白的稳定性。
H+-ATP酶(v-ATPase)介导溶酶体的囊泡酸化。溶酶体的酸化对于Wnt受体/共受体和APC的溶酶体降解是必需的,从而使Wnt/β-Catenin信号传导过度激活。因此,v-ATPase抑制剂的可以抑制Wnt/β-Catenin信号传导和肿瘤发生。
3.4. 靶向β-Catenin及其转录合作因子
β-Catenin通过与其转录合作因子TCF/LEF形成复合物而发挥作用。β-Catenin还招募cAMP反应元件结合蛋白(CBP)和p300等共激活因子。这些因子的相互作用对于β-Catenin转录反应的完全激活至关重要。因此,阻断这些相互作用可能是抑制Wnt信号的策略。
ICG-001及其类似物PRI-724干扰β-Catenin和CBP之间的相互作用。
BCL9的稳定α螺旋(SAH-BCL9)可阻碍β-Catenin和转录共激活因子BCL9之间的相互作用。
维生素D3(1.25脱氢维生素D3)也破坏了-连环蛋白和TCF-4之间的相互作用。维生素D受体与其配体结合,并与TCF-4竞争结合-连环蛋白。因此,维生素D3作为补充剂参与了多项同化疗的联合治疗临床试验。
尽管Wnt靶向存在许多限制,但新的Wnt信号通路靶向药物的临床试验也不断涌现,例如DKK1和FZD靶向抗体等。
4.1 使用PROTAC/分子胶的Wnt信号通路靶向
4.1.1 PROTAC
PROTAC是由E3连接酶、感兴趣的蛋白质(POI)和能够连接两种配体的链接器组成的双功能分子。E3连接酶对与PROTAC相互作用的POI进行泛素化,目标蛋白质最终通过蛋白酶体降解。
在使用PROTAC靶向Wnt中,β-Catenin是一个重要的细胞内靶标。xStAx-VHL是靶向β-Catenin的PROTAC,它由xStAx和VHLL组成。xStAx是一个与AXIN的β-Catenin结合域高度相似的肽,xStAx-VHL在细胞系和APC−/−类器官中诱导β-Catenin的剂量依赖性和持久性降解。
靶向Wnt的新技术(PROTACs, ADC和ASO)

靶向Wnt信号通路的新技术
β-Catenin靶向的PROTACs(xStAx-VHL)通过招募E3连接酶到β-Catenin,利用泛素-蛋白酶体系统诱导β-Catenin的降解。此外,β-Catenin与其E3连接酶β-TrCP的分子胶NRX-252114增强了β-Catenin的降解。针对LGR5或PTK7表达的Wnt响应细胞的ADCs(LGR5-mc-vc-PAB-MMAE、LGR5-NMs818和PF-06647020)结合到目标细胞并释放细胞毒性药物以诱导细胞死亡。ASO(LNA修饰的ASO、针对β-Catenin的ASO)结合到RNA的目标区域并抑制表达。
由于PROTAC不是基于平衡占位作用,因此其工作剂量非常低(nM浓度)。因此,与传统的抑制剂相比,PROTAC具有低毒性和高选择性的优势。
4.1.2 分子胶
诱导或稳定两种不同蛋白质之间的新相互作用的小分子称为“分子胶”。与PROTAC相比,分子胶在分子量方面具有更多的优势。
通常情况下,突变的β-Catenin无法与天然的E3连接酶β-TrCP结合。然而,β-Catenin分子胶NRX-252114恢复了这种相互作用,并诱导突变的β-Catenin的蛋白酶体降解。
4.1.3 其他蛋白质降解技术
最近,出现了各种蛋白质降解技术,例如PROTAB(蛋白质降解靶向抗体)、AUTOTAC(自噬靶向融合体)和LYTAC(溶酶体靶向融合体)。这些新平台未来可能在Wnt靶向癌症治疗中使用。
PROTAB是一种抗体,通过与跨膜E3连接酶ZNRF3结合来诱导细胞外靶受体的蛋白质降解,ZNRF3是Wnt信号通路的负调控因子。虽然这种平台并不直接靶向Wnt信号通路组分,但它可能适用于靶向Wnt通路的膜受体。
4.2. 基于抗体药物偶联物(ADC)的Wnt信号靶向
ADC通过诱导与抗体结合的抗原表达细胞的凋亡来杀伤细胞。ADC结合了单克隆抗体和细胞毒性药物的优点,能够更精确有效地靶向和消除靶细胞。
Septuximab vedotin(F7-ADC)是用于靶向FZD7的ADC。它包含人源FZD7抗体和微管抑制剂MMAE。卵巢浆液性囊腺癌过度表达Wnt受体FZD7, Septuximab vedotin(F7-ADC)在体外和体内杀伤卵巢癌细胞而不产生毒性。
PTK7是Wnt配体的共受体。靶向PTK7适用于特异性靶向Wnt响应的癌干细胞(CSCs)。PF-06647020是一种针对PTK7的ADC。PF-06647020能够有效地传递抗癌药物,并在各种癌细胞系和PDX(非小细胞肺癌、卵巢癌和三阴性乳腺癌)中显示出抗癌效果。
LGR5靶向的ADC,LGR5–MC-vc-PAB–MMAE和LGR5–NMS818,LGR5靶向的ADC靶向表达LGR5的肿瘤干细胞。尽管这些ADC并不直接抑制Wnt信号通路,但它们能够消灭Wnt响应细胞(如CSCs)。此外,这些LGR5靶向的ADC能够显著抑制肿瘤的生长和复发。
4.3. 寡核苷酸靶向的Wnt信号靶向
4.3.1. miRNA和siRNA
miRNA和siRNA由短序列组成,通过部分碱基配对靶向RNA。miR-15a和miR-16-1是肿瘤抑制因子,并在前列腺癌细胞中下调Wnt3a。
TargomiRs是包含miR-16基序列的微小RNA,有23个碱基对,靶向细胞表面的EGFR和Wnt3a。TargomiRs已经在恶性胸膜间皮瘤和非小细胞肺癌的复发治疗方面完成了临床试验。
Myc是β-Catenin依赖的Wnt通路的核心效应蛋白。DCR-Myc是一种抗-Myc DsiRNA(Dicer基质小干扰RNA),能够在体内抑制肿瘤生长。
4.3.2. 反义寡核苷酸
反义寡核苷酸(ASO)是由16-22个碱基组成的单链DNA类似物。ASO通过与靶向RNA序列结合并通过各种机制控制其表达。
LNA修饰的ASO是Wnt通路的间接靶向ASO。长链非编码RNA(lncRNA)AC10401.1在头颈鳞状细胞癌(HNSCC)中高度表达,并与HNSCC患者的不良预后相关。它在细胞质中作为与miR-6817-3d的竞争性内源性RNA,增加了Wnt2B的稳定性,从而激活了经典Wnt通路。此外,LNA修饰的ASO与Wnt信号抑制剂的联合应用可以抑制AC10401.1并抑制细胞系和患者源异种移植模型中的肿瘤细胞生长。因此,LNA-ASO有潜力通过靶向Wnt信号来抑制肿瘤发生。
2'-O-甲氧基乙基嵌合ASO可直接靶向β-Catenin。体内研究数据也表明,2'-O-甲氧基乙基嵌合ASO可以特异性靶向β-Catenin。
由于Wnt信号通路具有广泛的生理功能,靶向Wnt可能导致治疗的多种副作用。因此,近期的Wnt靶向方法侧重于增加治疗的特异性,减少副作用。
PROTAC/分子胶、ASO和ADC引入到Wnt靶向治疗后,增加了靶向的特异性。这三种方法可帮助改善现有靶向策略的局限性。
药物的研发在于不断突破。基于新的技术及对Wnt信号知识的积累,靶向Wnt信号通路的新肿瘤治疗方法的出现是值得期待的。
扫码查看BPS Bioscience Wnt蛋白、检测试剂盒、细胞系相关产品
编译自:
1. New Wave of Targeting ‘Undruggable’ Wnt Signaling for Cancer Therapy: Challenges and Opportunities. Cells 2023,12,1110.
2.https://bpsbioscience.com/research-areas/wnt-signaling-pathway



